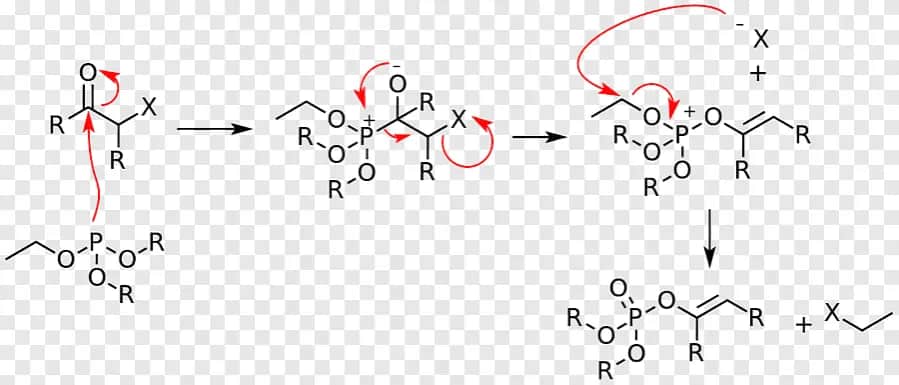
Reakcja Wittiga to kluczowa metoda w syntezie organicznej, umożliwiająca tworzenie alkenów z aldehydów lub ketonów. Odkryta w 1954 roku przez Georga Wittiga, przyniosła mu Nagrodę Nobla. Polega na reakcji ylidów fosforowych z związkami karbonylowymi. Jej mechanizm obejmuje dodanie nukleofilowe, utworzenie czteroczłonowego pierścienia i jego rozpad. Reakcja ta jest szeroko stosowana ze względu na precyzję w tworzeniu wiązań węgiel-węgiel.
Najważniejsze informacje:
- Umożliwia syntezę alkenów z aldehydów i ketonów
- Wykorzystuje ylidy fosforowe jako reagenty
- Mechanizm obejmuje trzy główne etapy
- Pozwala na precyzyjne określenie położenia podwójnego wiązania
- Szeroko stosowana w syntezie organicznej
- Ma pewne ograniczenia, np. przy reakcjach z niektórymi ketonami
Na czym polega reakcja Wittiga
Reakcja Wittiga to kluczowy proces w syntezie organicznej, umożliwiający tworzenie alkenów z aldehydów lub ketonów. Odkryta w 1954 roku, stanowi przełom w chemii organicznej. Jej istotą jest wykorzystanie ylidów fosforowych jako reagentów.
Mechanizm reakcji Wittiga opiera się na nukleofilowym ataku ylidu na grupę karbonylową. To prowadzi do utworzenia pośredniego związku, który następnie przekształca się w oksafosfetan. Finalnym etapem jest rozpad tego związku, dający alken i tlenek trifenylofosfiny.
Precyzja reakcji Wittiga w tworzeniu wiązań węgiel-węgiel czyni ją niezastąpioną w wielu procesach syntetycznych. Umożliwia ona kontrolowaną produkcję alkenów o określonej strukturze, co jest kluczowe w przemyśle farmaceutycznym i chemicznym.
- Wykorzystanie ylidów fosforowych jako reagentów
- Tworzenie alkenów z aldehydów i ketonów
- Precyzyjne określanie położenia podwójnego wiązania
- Mechanizm obejmujący etap tworzenia oksafosfetanu
- Szeroka aplikacja w przemyśle i badaniach naukowych
Georg Wittig - odkrywca procesu tworzenia alkenów
Georg Wittig, niemiecki chemik, urodził się w 1897 roku w Berlinie. Jego badania nad związkami fosforoorganicznymi doprowadziły do odkrycia reakcji nazwanej jego imieniem. Wittig rozpoczął swoją karierę naukową na Uniwersytecie w Marburgu, gdzie skupił się na chemii związków metaloorganicznych.
Przełomowe odkrycie reakcji Wittiga nastąpiło w 1954 roku, gdy pracował na Uniwersytecie w Heidelbergu. To osiągnięcie zrewolucjonizowało syntezę organiczną. Za swoje badania nad ylidami fosforowymi i ich zastosowaniem w syntezie związków organicznych, Wittig otrzymał w 1979 roku Nagrodę Nobla w dziedzinie chemii.
Ciekawostka: Georg Wittig podzielił się Nagrodą Nobla z Herbertem C. Brownem, który prowadził niezależne badania nad związkami boroorganicznymi. Ich wspólne wyróżnienie podkreśliło znaczenie chemii metaloorganicznej w rozwoju syntezy organicznej.
Czytaj więcej: Franciszek Dera: Nieznany bohater lokalnej społeczności
Mechanizm tworzenia wiązań węgiel-węgiel
Mechanizm reakcji Wittiga to fascynujący proces chemiczny. Rozpoczyna się od nukleofilowego ataku ylidu fosforowego na grupę karbonylową aldehydu lub ketonu. Ten etap inicjuje serię przekształceń prowadzących do utworzenia nowego wiązania węgiel-węgiel.
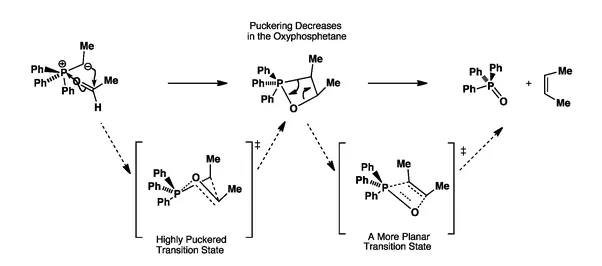
Kluczowym pośrednim produktem jest betaina, która szybko przekształca się w oksafosfetan. Ta cykliczna struktura jest nietrwała i spontanicznie rozpada się, uwalniając pożądany alken. Cały proces charakteryzuje się wysoką stereospecyficznością, co czyni go cennym narzędziem w syntezie organicznej.
| Reagenty | Produkty |
| Ylid fosforowy | Alken |
| Aldehyd lub keton | Tlenek trifenylofosfiny |
Reakcja Wittiga przebiega w kilku etapach. Najpierw następuje addycja nukleofilowa ylidu do grupy karbonylowej. Następnie tworzy się nietrwały oksafosfetan, który ulega szybkiemu rozpadowi.
Finalnym produktem jest alken oraz tlenek trifenylofosfiny. Stereoselektywność reakcji zależy od rodzaju użytego ylidu i warunków prowadzenia procesu.
Ylidy fosforowe w reakcji Wittiga
Ylidy fosforowe są kluczowymi reagentami w reakcji Wittiga. Te związki charakteryzują się obecnością ładunku ujemnego na atomie węgla i dodatniego na fosforze. Ich reaktywność wynika z nukleofilowego charakteru atomu węgla.
W syntezie organicznej stosuje się różne typy ylidów. Najpopularniejsze są ylidy stabilizowane, semi-stabilizowane i niestabilizowane. Wybór odpowiedniego ylidu wpływa na stereochemię produktu końcowego.
Ylidy fosforowe można otrzymać poprzez deprotonację soli fosfoniowych. Proces ten zwykle wymaga użycia silnej zasady, takiej jak butylolitium lub wodorek sodu.
Właściwości ylidów fosforowych czynią je wyjątkowymi reagentami. Są one stosunkowo stabilne, ale jednocześnie wysoce reaktywne wobec grup karbonylowych. Ta dwoistość natury sprawia, że są idealne do kontrolowanej syntezy alkenów. Dodatkowo, ylidy można modyfikować, co pozwala na dostosowanie ich reaktywności do konkretnych potrzeb syntetycznych.
Etapy tworzenia oksafosfetanu
Tworzenie oksafosfetanu rozpoczyna się od ataku nukleofilowego. Ylid fosforowy atakuje grupę karbonylową aldehydu lub ketonu, tworząc wiązanie węgiel-węgiel.
Następnie zachodzi szybka reorganizacja elektronów. Prowadzi to do utworzenia czteroczłonowego pierścienia zawierającego atomy węgla, tlenu i fosforu.
Oksafosfetan jest nietrwałym związkiem pośrednim. Jego struktura napięta energetycznie sprzyja szybkiemu rozpadowi na produkty końcowe.
Rozpad oksafosfetanu prowadzi do powstania alkenu. Jednocześnie uwalnia się tlenek trifenylofosfiny jako produkt uboczny reakcji Wittiga.
- Temperatura reakcji: zwykle od 0°C do temperatury pokojowej
- Rozpuszczalniki: THF, eter dietylowy, DMSO
- Czas reakcji: od kilku minut do kilku godzin
- pH środowiska: neutralne lub lekko zasadowe
Zastosowanie reakcji w syntezie organicznej
Reakcja Wittiga znajduje szerokie zastosowanie w syntezie organicznej. Jest szczególnie cenna przy tworzeniu złożonych cząsteczek zawierających wiązania podwójne. W przemyśle farmaceutycznym wykorzystuje się ją do produkcji leków i związków biologicznie czynnych.
W przemyśle kosmetycznym reakcja Wittiga służy do syntezy witaminy A i jej pochodnych. Te związki są kluczowe w produkcji kremów przeciwzmarszczkowych i innych preparatów pielęgnacyjnych. Dodatkowo, w chemii materiałowej stosuje się ją do tworzenia monomerów dla zaawansowanych polimerów.
Naukowcy wykorzystują reakcję Wittiga w badaniach nad nowymi materiałami. Umożliwia ona syntezę związków o specyficznych właściwościach optycznych i elektronicznych. To otwiera drogę do rozwoju nowych technologii, takich jak organiczne diody elektroluminescencyjne (OLED).
| Przykład syntezy | Produkt |
| Witamina A | Retinol |
| Leki przeciwnowotworowe | Tamoksyfen |
| Feromony owadów | E-8-dodecenyl acetat |
W przemyśle, reakcja Wittiga często jest prowadzona w dużej skali. Wymaga to optymalizacji warunków reakcji i doboru odpowiednich rozpuszczalników. Kluczowe jest również opracowanie efektywnych metod oczyszczania produktów.
Znaczenie reakcji Wittiga w przemyśle ciągle rośnie. Naukowcy pracują nad nowymi zastosowaniami, szczególnie w obszarze zielonej chemii i zrównoważonego rozwoju.
Produkty uboczne i ich wykorzystanie
Głównym produktem ubocznym reakcji Wittiga jest tlenek trifenylofosfiny. Ten związek, choć często uważany za odpad, ma potencjalne zastosowania. W niektórych procesach używa się go jako katalizatora w reakcjach utleniania.
Tlenek trifenylofosfiny można również przekształcić z powrotem w trifenylofosfinę. Ten proces recyklingu jest ważny z ekonomicznego i ekologicznego punktu widzenia. Pozwala na ponowne wykorzystanie fosforu, który jest cennym i ograniczonym zasobem.
Recykling produktów ubocznych reakcji Wittiga zyskuje na znaczeniu. Opracowywane są nowe metody odzyskiwania i przekształcania tlenku trifenylofosfiny. Niektóre z nich wykorzystują mikroorganizmy do biodegradacji związków fosforowych. Inne podejścia skupiają się na chemicznej redukcji tlenku do formy aktywnej fosforanu.
Ograniczenia i trudności w reakcji Wittiga
Reakcja Wittiga ma pewne ograniczenia. Jednym z nich jest trudność w przeprowadzaniu reakcji z ketonami sterycznie zatłoczonymi. W takich przypadkach wydajność reakcji może być niska.
Innym problemem jest selektywność geometryczna produktów. Kontrola nad tworzeniem izomerów E i Z może być wyzwaniem, szczególnie przy użyciu niestabilizowanych ylidów.
Obecność grup funkcyjnych wrażliwych na zasady może komplikować reakcję Wittiga. Wymaga to starannego doboru warunków reakcji lub stosowania grup ochronnych.
Naukowcy opracowują modyfikacje reakcji Wittiga, aby przezwyciężyć te ograniczenia. Jednym z podejść jest użycie alternatywnych rozpuszczalników, takich jak ciecze jonowe. Innym jest zastosowanie katalizatorów metali przejściowych do poprawy selektywności.
Nowoczesne techniki, takie jak chemia przepływowa, oferują nowe możliwości optymalizacji reakcji Wittiga. Pozwalają na lepszą kontrolę nad warunkami reakcji i łatwiejsze skalowanie procesów. Dodatkowo, metody komputerowe pomagają w przewidywaniu i optymalizacji warunków reakcji.
Modyfikacje procesu
Jedną z ważnych modyfikacji jest reakcja Hornera-Wadswortha-Emmonsa. Wykorzystuje ona fosforany zamiast ylidów, co często prowadzi do lepszej stereoselektywności. Ta wersja jest szczególnie przydatna w syntezie α,β-nienasyconych estrów.
Inną modyfikacją jest reakcja Julii-Kocienskiego. Używa ona sulfonów zamiast związków fosforowych, co ułatwia oczyszczanie produktów. Ta metoda jest często preferowana w syntezie dużych cząsteczek.
Naukowcy eksperymentują z zastosowaniem mikrofalowego ogrzewania w reakcji Wittiga. Ta technika może znacznie skrócić czas reakcji i poprawić wydajność. Dodatkowo, pozwala na prowadzenie reakcji w bardziej ekologicznych warunkach.
Nowoczesne metody obejmują również użycie enzymów w syntezie organicznej. Biokatalizatory mogą poprawić stereoselektywność reakcji i umożliwić jej prowadzenie w łagodniejszych warunkach. To podejście jest szczególnie obiecujące w kontekście zielonej chemii.
Reakcja Wittiga: Klucz do syntezy alkenów w chemii organicznej
Reakcja Wittiga stanowi fundamentalne narzędzie w syntezie organicznej, umożliwiając precyzyjne tworzenie wiązań podwójnych węgiel-węgiel. Odkryta przez Georga Wittiga w 1954 roku, ta metoda zrewolucjonizowała podejście do produkcji alkenów, znajdując szerokie zastosowanie w przemyśle farmaceutycznym, kosmetycznym i materiałowym.
Mechanizm reakcji, oparty na wykorzystaniu ylidów fosforowych, pozwala na kontrolowaną syntezę alkenów z aldehydów i ketonów. Mimo pewnych ograniczeń, takich jak trudności w reakcjach z zatłoczonymi ketonami czy wyzwania związane z selektywnością geometryczną, reakcja Wittiga pozostaje kluczowym procesem w chemii organicznej. Modyfikacje, takie jak reakcja Hornera-Wadswortha-Emmonsa czy Julii-Kocienskiego, oraz nowe technologie, w tym chemia przepływowa i biokatalizatory, stale rozszerzają możliwości tej wszechstronnej metody syntetycznej.
Znaczenie reakcji Wittiga wykracza poza laboratorium, odgrywając istotną rolę w produkcji leków, kosmetyków i zaawansowanych materiałów. Jej ciągły rozwój i adaptacja do nowych wyzwań chemii zrównoważonej podkreślają jej nieustającą wartość w nowoczesnej nauce i przemyśle.